염소[chlorine, 鹽素 ] (기호 : Cl)
23,699
2022.09.20 13:56
첨부파일
-
- 첨부파일: K-001.png (54.7K)132 2022-09-20 14:01:51
짧은주소
본문
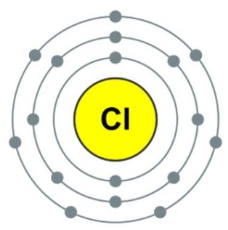
원소주기율표 상에서 3주기 17족에 속하는 할로젠족 원소로 원소기호는 Cl, 녹는점은 -101.5℃, 끓는점은 -34.04℃, 밀도는 3.2g/L이다. 전기음성도가 플루오린, 산소 다음으로 크고 자극적인 냄새가 나는 녹황색 기체이다. 염소분자(Cl2)는 강력한 산화제이며 표백제로 쓰인다.
바닷물이나 생물체 내에서는 이온상태(Cl-)로 존재하며 소금의 주요 성분으로, 자연계에 널리 분포하며, 특히 생명에게 필수적 요소이다. 반응성이 커서 비활성기체를 제외하고 거의 모든 원소와 반응하며 금속원소와 이온결합하여 이온성화합물을 만들고 비금속원소와 결합하여 유기화합물을 만든다.
상온에서 염소원자는 염소원자 두 개가 단일 결합한 이원자 염소분자(Cl2)로 존재한다. 염소가스는 황록색의 독성을 가진 심한 자극적인 냄새를 가진 기체로, 제 1차 세계대전에서 화학전에 사용되어 수많은 사람들을 질식시켰다.
식물에서 염소는 광합성 과정에서 산소발생과 광인산화작용에 관여하며 식물의 요구량이 매우 작아서 결핍이 거의 안 되지만, 결핍 시에는 증산작용에 영향을 끼쳐서 잎 끝이 시들고 잎이 누렇게 변하기도 한다.
우리 몸에서 염소는 신경을 통해 자극을 전달 시킬 때 영향을 주며 혈장과 위액의 구성성분이 된다. 또한 생물체 내에서 주로 음이온(Cl-)으로 존재하며, 칼륨이나 나트륨 등과 함께 삼투압을 조절하는 등 생물의 물질대사에 반드시 필요한 무기물질이다.
염소는 소금(NaCl)에 주로 함유되어 있고, 결핍 때에는 구토, 설사 및 부신피질에 질환이 생기며 과잉섭취 했을 때는 탈수, 고혈압, 위산과다, 위궤양 등의 질환이 생길 수 있다.
반응성이 크고 다른 물질을 산화시키므로 산화제로 쓰이며 살균·소독 작용이 있어 살균·소독제로도 사용된다. 염산의합성재료나 표백분의 원료로 이용되고 있으며 염소화합물이나 금속염화물의 제조에도 널리 쓰인다.
염소는 공기 중에 0.003-0.006%만 존재해도 호흡기 점막이 상하며 장시간 노출되면 호흡곤란 증세가 발생한다. 직접 흡입해서는 안되며 취급에 각별한 주의가 필요하다.
바닷물이나 생물체 내에서는 이온상태(Cl-)로 존재하며 소금의 주요 성분으로, 자연계에 널리 분포하며, 특히 생명에게 필수적 요소이다. 반응성이 커서 비활성기체를 제외하고 거의 모든 원소와 반응하며 금속원소와 이온결합하여 이온성화합물을 만들고 비금속원소와 결합하여 유기화합물을 만든다.
상온에서 염소원자는 염소원자 두 개가 단일 결합한 이원자 염소분자(Cl2)로 존재한다. 염소가스는 황록색의 독성을 가진 심한 자극적인 냄새를 가진 기체로, 제 1차 세계대전에서 화학전에 사용되어 수많은 사람들을 질식시켰다.
식물에서 염소는 광합성 과정에서 산소발생과 광인산화작용에 관여하며 식물의 요구량이 매우 작아서 결핍이 거의 안 되지만, 결핍 시에는 증산작용에 영향을 끼쳐서 잎 끝이 시들고 잎이 누렇게 변하기도 한다.
우리 몸에서 염소는 신경을 통해 자극을 전달 시킬 때 영향을 주며 혈장과 위액의 구성성분이 된다. 또한 생물체 내에서 주로 음이온(Cl-)으로 존재하며, 칼륨이나 나트륨 등과 함께 삼투압을 조절하는 등 생물의 물질대사에 반드시 필요한 무기물질이다.
염소는 소금(NaCl)에 주로 함유되어 있고, 결핍 때에는 구토, 설사 및 부신피질에 질환이 생기며 과잉섭취 했을 때는 탈수, 고혈압, 위산과다, 위궤양 등의 질환이 생길 수 있다.
반응성이 크고 다른 물질을 산화시키므로 산화제로 쓰이며 살균·소독 작용이 있어 살균·소독제로도 사용된다. 염산의합성재료나 표백분의 원료로 이용되고 있으며 염소화합물이나 금속염화물의 제조에도 널리 쓰인다.
염소는 공기 중에 0.003-0.006%만 존재해도 호흡기 점막이 상하며 장시간 노출되면 호흡곤란 증세가 발생한다. 직접 흡입해서는 안되며 취급에 각별한 주의가 필요하다.






댓글목록
등록된 댓글이 없습니다.