코발트[cobalt ] (기호 Co)
20,877
2022.11.25 11:53
첨부파일
-
- 첨부파일: K-002.png (41.7K)140 2022-11-25 11:58:20
짧은주소
본문
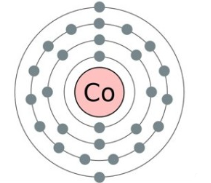
주기율표 9족 4주기에 속하는 철족원소(鐵族元素)로 원소기호는 Co, 원자량 58.933g/mol, 녹는점 1495℃, 끓는점 2927℃, 밀도 8.90g/cm3 이다. 철과 비슷한 광택이 나는 전이금속으로 옛날에는 도자기나 유리 등에 푸른색을 내는 화합물로서 알려져 있었으며 비타민 B12(cobalamin)의 필수구성요소로 결핍 때 악성빈혈을 일으킨다.
코발트는 단단하고 엷은 푸른색을 띠는 은회색 금속으로, 철(Fe), 니켈과 겉모양이 비슷하다. 잡아 늘리기 쉬운 성질(연성)을 가지며, 펴 늘리기 쉬운 성질(전성)도 약간 있다. 철, 니켈과 함께 실온에서 강자성인 3가지 원소 중의 하나이다. 가돌리늄(Gd)도 강자성 원소이기는 하나, 퀴리 온도(자석 성질을 띠는 최대 온도)가 약 27oC로 실온에서 자석으로 사용하기는 거의 불가능하다. 강자성 물질은 영구 자석이 될 수 있는데, Co의 퀴리 온도는 1,130oC로, Fe의 770oC, Ni의 380oC보다 월등히 높다. 조밀육방격자(hcp) 구조인 α-형과 면심입방격자(fcc) 구조인 β-형의 두 가지 동소체가 있으며, hcp구조에서 fcc구조로의 전이는 450oC에서 일어나나 이들 구조 사이의 에너지 차이가 적고 구조 전이가 느리기 때문에 코발트는 보통 두 구조가 섞여있는 형태로 얻어진다. β-형은 약간의 Fe을 첨가하면 안정화된다. 이 때문에 코발트에 대해 보고된 물리적 성질이 연구자들마다 약간씩 다르다. 녹는점은 1,495oC이고 끓는점은 2,927oC이며, 20oC에서 밀도는 8.90g/cm3이다.
천연 상태에서 코발트는 안정한 동위원소인 59Co로만 있다. 여러 가지 인공 동위원소들이 합성되었는데, 이중에서 가장 중요한 것이 반감기가 5.27년인 60Co이다. 이 방사성 동위원소는 농축된 감마(γ)-선원으로 여러 분야에 널리 사용된다.
코발트의 반응성은 철보다 작으며, 실온에서 대기 중의 산소나 물과 반응하지 않는다. 그러나 가열하면 산소와 반응하여 처음에는 Co3O4가 생성되는데, 이는 900oC 이상에서는 CoO와 산소로 분해된다. 빨갛게 달군 금속 Co와 수증기의 반응에서도 CoO가 생성된다. 묽은 산에 천천히 녹아 Co2+ 이온이 되면서 수소 기체를 발생시킨다. 가열하면 할로겐 원소, 붕소(B), 탄소(C), 인(P), 비소(As), 황(S) 등의 비금속 원소들과 반응하나, H2와 N2와는 반응하지 않는다.
코발트는 주로 구리와 니켈 생산의 부산물로 얻어진다. 따라서 코발트의 생산 방법은 주 생산 금속의 종류와 광석에서의 코발트 함량에 따라 크게 달라진다. 구리 광석인 경우의 한 가지 방법은 구리를 전기 분해로 회수하고 남은 용액에 석회(CaO)를 첨가하여 철을 Fe(OH)3로 침전시켜 제거한 후, 남은 용액을 다시 높은 전압으로 전기분해시켜 코발트를 회수하는 것이다. 니켈 광석의 경우는 여러 단계의 과정을 거친 후 음이온 교환 방법을 써서 코발트를 [CoCl4]2- 형태로 분리한다.
코발트는 단단하고 엷은 푸른색을 띠는 은회색 금속으로, 철(Fe), 니켈과 겉모양이 비슷하다. 잡아 늘리기 쉬운 성질(연성)을 가지며, 펴 늘리기 쉬운 성질(전성)도 약간 있다. 철, 니켈과 함께 실온에서 강자성인 3가지 원소 중의 하나이다. 가돌리늄(Gd)도 강자성 원소이기는 하나, 퀴리 온도(자석 성질을 띠는 최대 온도)가 약 27oC로 실온에서 자석으로 사용하기는 거의 불가능하다. 강자성 물질은 영구 자석이 될 수 있는데, Co의 퀴리 온도는 1,130oC로, Fe의 770oC, Ni의 380oC보다 월등히 높다. 조밀육방격자(hcp) 구조인 α-형과 면심입방격자(fcc) 구조인 β-형의 두 가지 동소체가 있으며, hcp구조에서 fcc구조로의 전이는 450oC에서 일어나나 이들 구조 사이의 에너지 차이가 적고 구조 전이가 느리기 때문에 코발트는 보통 두 구조가 섞여있는 형태로 얻어진다. β-형은 약간의 Fe을 첨가하면 안정화된다. 이 때문에 코발트에 대해 보고된 물리적 성질이 연구자들마다 약간씩 다르다. 녹는점은 1,495oC이고 끓는점은 2,927oC이며, 20oC에서 밀도는 8.90g/cm3이다.
천연 상태에서 코발트는 안정한 동위원소인 59Co로만 있다. 여러 가지 인공 동위원소들이 합성되었는데, 이중에서 가장 중요한 것이 반감기가 5.27년인 60Co이다. 이 방사성 동위원소는 농축된 감마(γ)-선원으로 여러 분야에 널리 사용된다.
코발트의 반응성은 철보다 작으며, 실온에서 대기 중의 산소나 물과 반응하지 않는다. 그러나 가열하면 산소와 반응하여 처음에는 Co3O4가 생성되는데, 이는 900oC 이상에서는 CoO와 산소로 분해된다. 빨갛게 달군 금속 Co와 수증기의 반응에서도 CoO가 생성된다. 묽은 산에 천천히 녹아 Co2+ 이온이 되면서 수소 기체를 발생시킨다. 가열하면 할로겐 원소, 붕소(B), 탄소(C), 인(P), 비소(As), 황(S) 등의 비금속 원소들과 반응하나, H2와 N2와는 반응하지 않는다.
코발트는 주로 구리와 니켈 생산의 부산물로 얻어진다. 따라서 코발트의 생산 방법은 주 생산 금속의 종류와 광석에서의 코발트 함량에 따라 크게 달라진다. 구리 광석인 경우의 한 가지 방법은 구리를 전기 분해로 회수하고 남은 용액에 석회(CaO)를 첨가하여 철을 Fe(OH)3로 침전시켜 제거한 후, 남은 용액을 다시 높은 전압으로 전기분해시켜 코발트를 회수하는 것이다. 니켈 광석의 경우는 여러 단계의 과정을 거친 후 음이온 교환 방법을 써서 코발트를 [CoCl4]2- 형태로 분리한다.






댓글목록
등록된 댓글이 없습니다.