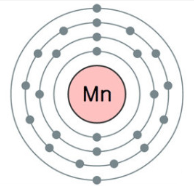
망가니즈 [manganese망간] (기호 Mn)
22,506
2022.11.15 10:14
첨부파일
-
- 첨부파일: K-002.png (46.8K)139 2022-11-15 10:20:22
짧은주소
본문
주기율표 7족 4주기에 속하는 전이원소로 원소기호 Mn, 원자번호 25번인 Mn은 얼마 전까지 망간이라 불렀으나, 현재는 IUPAC(국제 순수ㆍ응용화학 연합) 명명법에 따라 망가니즈(manganese)라 부른다. 화학을 공부한 대부분의 사람은 화학실험에서 산소(O2)를 얻을 때 촉매로 사용하는 검은색의 이산화 망가니즈(이산화 망간, MnO2)와 산화-환원 적정에 많이 쓰이는 보라색의 과망가니즈산 포타슘(과망간산 칼륨, KMnO4)을 기억해 낼 수 있을 것이다. 또 건전지(알칼리 전지 포함)에도 MnO2를 사용한다는 것을 한번쯤 들은 적이 있을 것이다. 원소 망가니즈의 주된 용도는 철과 합금을 만들어 각종 기계, 철도레일, 강판 등의 제조에, 그리고 알루미늄과 합금을 만들어 음료수 캔 등의 제조에 쓰이는 것이다. 망가니즈는 모든 생물에게 미량으로 필요한 필수 영양소인 반면, 너무 많은 양이 몸 안으로 들어오면 영구적인 신경 장애를 일으키는 독성 금속이기도 한다.
강철 합금과 건전지에 쓰이는 원소이다.거의 모든 강철에는 Mn이 들어간다. 강철에서 Mn은 두 가지 역할을 하는데, 하나는 황(S)과 결합하여 MnS로 만들어 슬래그로 제거시킴으로써 강철의 부서짐 성질의 요인인 FeS의 형성을 막고, 또 냉연강(cold steel)에서 산소와 MnO를 만들어 기포나 미세 구멍이 생기는 것을 막는 것이다.
망가니즈는 단단하나 쉽게 부서지는 은색 금속이다.
망가니즈는 주기율표에서 이웃하는 다른 원소들에 비해 전자를 잃는 성질(전기양성)이 크고, 따라서 반응성이 크다.
망가니즈의 90% 이상은 철강 산업에서 합금을 만드는 데 사용된다.
태평양 해저에 약 5000억 톤의 망가니즈 단괴(manganese nodule)가 있고, 매년 약 100만 톤이 새롭게 퇴적되는 것으로 추정되고 있다.
망가니즈는 모든 생물체에 필수적인 미량 영양소이다. Mn은 생체 내에서 산화-환원, 전달, 분해, 연결, 이성질화 등 여러 유형의 생체내 반응을 촉매하는 효소들의 보조인자로 작용한다.
강철 합금과 건전지에 쓰이는 원소이다.거의 모든 강철에는 Mn이 들어간다. 강철에서 Mn은 두 가지 역할을 하는데, 하나는 황(S)과 결합하여 MnS로 만들어 슬래그로 제거시킴으로써 강철의 부서짐 성질의 요인인 FeS의 형성을 막고, 또 냉연강(cold steel)에서 산소와 MnO를 만들어 기포나 미세 구멍이 생기는 것을 막는 것이다.
망가니즈는 단단하나 쉽게 부서지는 은색 금속이다.
망가니즈는 주기율표에서 이웃하는 다른 원소들에 비해 전자를 잃는 성질(전기양성)이 크고, 따라서 반응성이 크다.
망가니즈의 90% 이상은 철강 산업에서 합금을 만드는 데 사용된다.
태평양 해저에 약 5000억 톤의 망가니즈 단괴(manganese nodule)가 있고, 매년 약 100만 톤이 새롭게 퇴적되는 것으로 추정되고 있다.
망가니즈는 모든 생물체에 필수적인 미량 영양소이다. Mn은 생체 내에서 산화-환원, 전달, 분해, 연결, 이성질화 등 여러 유형의 생체내 반응을 촉매하는 효소들의 보조인자로 작용한다.






댓글목록
등록된 댓글이 없습니다.