인[Phosphorus, 燐 ] (기호 P)
28,299
2022.09.08 08:47
첨부파일
-
- 첨부파일: K-002.png (47.9K)144 2022-09-15 08:34:06
짧은주소
본문
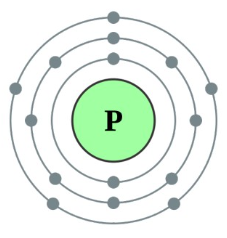
주기율표 15족 3주기에 속하는 원소로 원소기호는 P, 원자량은 30.974 g/mol, 녹는점 44.2℃, 끓는점 280.5℃,
밀도는 1.823 g/cm3이다. 자연상태에서 홑원소 상태로는 존재하지 않으며, 여러 개의 동소체 흰색, 붉은색,
검은색 인이 존재한다.
동물에는 뼈·이 등의 주요 성분이고, 또 피틴·인지질(燐脂質)·인단백질·핵산(核酸) 등의 중요한 유기화합물로서 체내에 함유되어 있고 식물에는 0.2∼0.8% 함유되어 있다. 자연 상태에서 홑원소 상태로는 존재하지 않으며, 산소와 화합한 상태로 존재하거나 인회석에 포함되어 있다.
인은 물리적·화학적 성질이 다른 여러 동소체가 있다. 그 중에서 크게 흰색인(노란색인), 붉은색인, 검은색인(보라색 인) 세 가지가 있다. 순수한 흰색인은 양초와 같은 투명한 고체로 네 개의 인원소(P4)가 사면체 구조를 이루고 있다. 동소체들 중에서 가장 불안정하여 붉은색인으로 점차적으로 변환되는데 이런 변환은 열과 빛에 의해 가속된다. 이런 이유로 흰색인은 항상 붉은인을 적은 양 포함하고 있어 노란색을 띤다. 붉은인은 가루 형태로 존재하며 흰색인을 촉매 존재하에 250℃로 가열하거나 햇빛에 노출시켜 얻을 수 있으며 416℃에서 승화하며 밀도는 2.34g/cm3이며 대부분의 액체에 녹지 않는다. 흰색인에서 검은색인(보라색인)으로 변환하는 중간체라고 할 수 있다. 동소체 중 가장 안정한 검은색(보라색)인은 흑연처럼 보이며 흰색인에 고압을 가하여 얻으며 특이한 성질로 비금속임에도 전기전도성이 있다.
인화성이 커서 공기와 접촉하면 자연발화하여 초록빛의 인광을 내며 특이한 마늘 냄새가 난다. 진공상태에서 빛에 노출시키면 승화가 일어난다. 물에 녹지 않고 벤젠이나 클로로포름에 녹는다. 화학적으로 활성(活性)이며, 공기 중에서는 50℃에서 발화 연소하여 산화물인 오산화인 P2O5이 되므로 물이 들어 있는 병 속에 보관한다. 또, 탄소·질소 등을 제외한 대부분의 원소와 직접 화합하는데, 특히 할로겐·황·산소 등과는 격렬하게 화합한다. 진한 질산에 녹아 인산이 되고, 진한 알칼리에서는 포스핀을 발생한다
흰색인은 인산·적린 등의 제조원료나 살서제(殺鼠劑)로서 사용되고, 붉은색은 성냥 제조, 인청동(燐靑銅) 등의 제조, 인을 함유하는 각종 농약의 합성 등에 사용된다. 또, 인산으로서는 각종 인산염의 제조, 특히 인산나트륨·중합인산나트륨으로서 세제용으로 대량 사용되고 있다.
밀도는 1.823 g/cm3이다. 자연상태에서 홑원소 상태로는 존재하지 않으며, 여러 개의 동소체 흰색, 붉은색,
검은색 인이 존재한다.
동물에는 뼈·이 등의 주요 성분이고, 또 피틴·인지질(燐脂質)·인단백질·핵산(核酸) 등의 중요한 유기화합물로서 체내에 함유되어 있고 식물에는 0.2∼0.8% 함유되어 있다. 자연 상태에서 홑원소 상태로는 존재하지 않으며, 산소와 화합한 상태로 존재하거나 인회석에 포함되어 있다.
인은 물리적·화학적 성질이 다른 여러 동소체가 있다. 그 중에서 크게 흰색인(노란색인), 붉은색인, 검은색인(보라색 인) 세 가지가 있다. 순수한 흰색인은 양초와 같은 투명한 고체로 네 개의 인원소(P4)가 사면체 구조를 이루고 있다. 동소체들 중에서 가장 불안정하여 붉은색인으로 점차적으로 변환되는데 이런 변환은 열과 빛에 의해 가속된다. 이런 이유로 흰색인은 항상 붉은인을 적은 양 포함하고 있어 노란색을 띤다. 붉은인은 가루 형태로 존재하며 흰색인을 촉매 존재하에 250℃로 가열하거나 햇빛에 노출시켜 얻을 수 있으며 416℃에서 승화하며 밀도는 2.34g/cm3이며 대부분의 액체에 녹지 않는다. 흰색인에서 검은색인(보라색인)으로 변환하는 중간체라고 할 수 있다. 동소체 중 가장 안정한 검은색(보라색)인은 흑연처럼 보이며 흰색인에 고압을 가하여 얻으며 특이한 성질로 비금속임에도 전기전도성이 있다.
인화성이 커서 공기와 접촉하면 자연발화하여 초록빛의 인광을 내며 특이한 마늘 냄새가 난다. 진공상태에서 빛에 노출시키면 승화가 일어난다. 물에 녹지 않고 벤젠이나 클로로포름에 녹는다. 화학적으로 활성(活性)이며, 공기 중에서는 50℃에서 발화 연소하여 산화물인 오산화인 P2O5이 되므로 물이 들어 있는 병 속에 보관한다. 또, 탄소·질소 등을 제외한 대부분의 원소와 직접 화합하는데, 특히 할로겐·황·산소 등과는 격렬하게 화합한다. 진한 질산에 녹아 인산이 되고, 진한 알칼리에서는 포스핀을 발생한다
흰색인은 인산·적린 등의 제조원료나 살서제(殺鼠劑)로서 사용되고, 붉은색은 성냥 제조, 인청동(燐靑銅) 등의 제조, 인을 함유하는 각종 농약의 합성 등에 사용된다. 또, 인산으로서는 각종 인산염의 제조, 특히 인산나트륨·중합인산나트륨으로서 세제용으로 대량 사용되고 있다.






댓글목록
등록된 댓글이 없습니다.