붕소[Boron, 硼素 ] (기호 B)
23,218
2022.06.27 09:23
첨부파일
-
- 첨부파일: 붕소.jpg (14.4K)123 2022-06-27 09:25:45
짧은주소
본문
.
하이드레이티드 산화붕소나트륨(Na2B4O7.10H2O)으로 이루어진 붕사 결정 붕사는 소금 호수가 증발하는 동안 만들어진다.
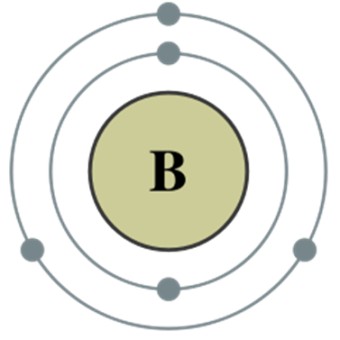
주기율표 13족에 2주기에 속하는 알루미늄족 원소로 원소기호는 B, 원자량은 10.8g/mol, 녹는점은 2076℃, 끓는점 3927℃이다.
자연계에 붕산 또는 붕산염으로서 널리 분포하며 동소체로 비결정성인 갈색 분말과 결정성인 흑색 고체가 존재한다.
역사
붕사 등 붕산염은 오래 전부터 알려져 있었고 1720년 붕사와 황산에서 붕산을 얻었다. 그후 붕소 홑원소물질로는 1807년 영국의 화학자 험프리 데이비가 붕산(H3BO3)을 전기분해하여 처음으로 추출하였다. 그는 처음에 붕산 boric acid의 이름을 따서 boracium이라는 이름을 제안하였으나 그 성질이 탄소 carbon과 비슷하여 boron이라 명명하게 되었다.
자연계에 홑원소물질로서는 존재하지 않으나, 붕산 또는 붕산염으로서 널리 분포한다. 붕산염 광물로는 붕사를 비롯하여 커나이트·코토아이트·수안석(遂安石)·자이벨리아이트 등이 있다. 또, 바닷물 속에도 소량이 함유되어 있으며 클라크수 제41위이다.
붕소는 비결정성인 갈색 분말과 결정성인 금속 광택이 있는 단단한 흑색 고체의 두 가지 동소체가 존재한다. 굳기는 9.3으로 다이아몬드(금강석) 다음이며 탄화붕소보다 단단하고 전기의 반도체이다. 화학적 성질은 규소와 비슷하며 반응성이 그다지 크지 않다. 진한 염산이나 플루오르화수소와는 가열해도 반응하지 않고 뜨거운 진한 질산이나 황산과 반응하여 붕산이 된다.
플루오르와는 상온에서 반응하며 염소와브롬과는 가온상태에서 직접 반응하나 요오드와는 반응하지 않는다. 산소 속에서는 700℃에서 빛을 발하면서 연소하고 황과는 600℃에서 반응한다. 질소 또는 암모니아와 가열하면 질화붕소가 되고 탄소·규소와는 고온에서 반응하여 붕소화물이 된다.
안정한 천연동위원소로 11B (80.1%) 과 10B (19.9%)가 존재한다.
제조법
붕소를 산화붕소로 만들어, 산화마그네슘과 함께 융해 플루오르화마그네슘에 녹인 것 등을 써서 전기분해하면 순도(純度)는99이상의 붕소 분말을 얻을 수 있다. 산화붕소를 나트륨이나 마그네슘 등으로 환원시키면 흑회색의 비결정 붕소가 생기는데 이 경우는 순도가 낮다.
붕소의 용도
홑원소물질로서는 별로 쓰이지 않고, 철과의 합금인 페로붕소는 제철공장 등에서 탈산제(脫酸劑)로 사용된다. 또, 열중성자 흡수 단면적이 크므로, 화합물을 만들어 중성자 흡수제로 쓰이며 유리의 원료를 비롯하여 붕산염으로서의 용도도 다양하다.
붕소는 원자로 냉각에 필수적인 물질로, 핵분열의 감속재로 쓰인다. 2011년 후쿠시마 원전 사태 때 한국 정부가일본에 붕소를지원해 주기도 했다.
군인들 방탄조끼 안에 들어 있는 보호판은 아주 강한 붕소카바이드 화합물로 만들어졌다.
붕소의 대표적 화합물인 붕사는 오래 전부터 도자기 유약의 재료로 사용되어 왔다.
붕산은 항균 및 항바이러스 성질이 있기 때문에 수영장의 물을 정화하는데도 이용된다






댓글목록
등록된 댓글이 없습니다.