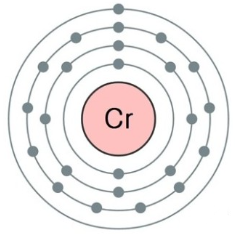
크롬(크로뮴)[chromium] (기호 Cr)
20,608
2022.11.07 14:34
첨부파일
-
- 첨부파일: K-001.png (66.5K)155 2022-11-07 14:41:23
짧은주소
본문
크로뮴(←영어: chromium 크로미엄[*]) 또는 크롬(←독일어: Chrom 크롬[*])은 주기율표의 6족에 속하는 화학 원소로 기호는 Cr(←라틴어: chromium 크로미움[*])이고 원자 번호는 24이다. 은색의 광택이 있는 단단한 전이 금속으로, 부서지기 쉬우며 잘 변색되지 않고 녹는점이 높다.
크로뮴 산화물은 2000년 전 중국의 진나라의 병마용에서 출토된 금속제 무기에 사용되었다. 서구 세계에서는 1761년 붉은색 결정형의 크로뮴산 납이 발견된 이후에 알려졌으며, 처음에는 염료로 사용되었다. 이후 1797년 프랑스의 화학자 루이 보클랭(Louis Nicolas Vauquelin)이 순수한 크로뮴을 분리하였다. 자연에서는 순수한 크로뮴이 희귀 광물 속에서 드물게 산출되기는 하지만 경제성이 없어 대부분 크롬철광(FeCr2O4)에서 얻는다.
크로뮴을 포함한 합금은 부식에 강하고 단단하기 때문에 활용 범위가 매우 넓다. 한 예로 스테인리스 스틸의 성분으로 크로뮴을 첨가하면 잘 부식되지 않고 변색되는 일이 적어 널리 쓰인다. 전기 도금에도 쓰이는데, 합금으로 사용하는 것까지 합하면 전체 크로뮴 사용량의 85%는 이러한 용도로 쓰인다.
크로뮴의 3가 양이온(Cr3+)은 체내에 미량 존재하며, 당분과 지질의 대사 과정에 필수적이라는 주장이 있으나 그에 대한 논란이 있다. Cr6+ 이온을 포함하는 크로뮴 화합물을 다량 흡입하면 독성을 나타내며 각종 암을 유발하기도 한다.
합금 및 도금
크로뮴을 각종 합금에 첨가물로 넣으면 잘 부식되지 않고 강도가 증가한다. 이 때문에 크로뮴은 도금과 합금 분야에 널리 쓰인다. 특히 철과의 합금으로 많이 사용되는데, 고속도강에는 3~5% 정도의 크로뮴이 첨가되며 스테인리스 스틸에는 보통 11% 이상 들어간다. 주로 용융된 철에 크로뮴철을 첨가하는 방식으로 제작한다.
순수한 크로뮴도 비교적 단단하고 부식에 강해 금속의 도금에도 많이 사용된다. 주로 전기도금 기술을 이용해 금속의 표면에 얇게 도금하는데, 1마이크로미터 정도로 얇게 도금하여 장식용으로 쓰는 경우와, 조금 더 두껍게 도금하여 표면이 잘 마모되지 않게 하는 용도로 나뉜다. 도금할 때는 크로뮴산 이온(CrO42-)이나 중크로뮴산 이온(Cr2O72-)이 사용된다. 그러나 환경오염 및 건강 문제 등을 유발할 수 있어 다른 도금 방법이 연구 중이다.
염색
크로뮴 화합물은 염료로 많이 사용된다. 대표적인 예로 크롬 옐로(PbCrO4)는 노란색을 내는데 가장 많이 쓰인 염료 중의 하나이다. 색이 강렬하므로 도로의 중앙선을 노랗게 칠할 때도 크롬 옐로를 사용하며, 미국이나 유럽에서는 학교 버스나 우편물 배달 차량을 칠할 때 사용한다. 또한, 프러시안 블루와 크롬 옐로를 섞으면 녹색의 Cr3+ 이온을 포함하는 산화물이 만들어지므로 크롬 그린의 제조에 사용된다. 이밖에 홍연석(PbCrO4·Pb(OH)2)에서 얻은 크롬 레드는 붉은색 염료로 많이 사용되었다. 그러나 크로뮴을 포함하는 염료는 환경오염 및 건강 문제를 유발할 수 있어 대부분 유기 화합물 등으로 대체되는 추세이다.
한편, 녹색의 크로뮴 산화물은 유리에 색을 넣거나 적외선을 반사하는 페인트로 사용한다. 특히 후자의 경우 식물의 녹색 잎과 비슷한 적외선 반사율을 나타내므로 군용 차량을 칠할 때 사용된다.
보석
소량의 크로뮴으로 인해 붉은색을 띠는 루비.
천연 루비는 산화 알루미늄 결정 속에 3가 크로뮴 이온이 포함되어 붉은색을 나타내는 것이다. 타이타늄과 철 이온이 포함되면 사파이어가 된다. 루비를 인공적으로 합성할 때도 같은 방법을 사용한다. 이러한 인조 루비는 1960년에 만들어진 최초의 레이저에도 사용되어 붉은색을 내는데 쓰였다.
크로뮴 산화물은 2000년 전 중국의 진나라의 병마용에서 출토된 금속제 무기에 사용되었다. 서구 세계에서는 1761년 붉은색 결정형의 크로뮴산 납이 발견된 이후에 알려졌으며, 처음에는 염료로 사용되었다. 이후 1797년 프랑스의 화학자 루이 보클랭(Louis Nicolas Vauquelin)이 순수한 크로뮴을 분리하였다. 자연에서는 순수한 크로뮴이 희귀 광물 속에서 드물게 산출되기는 하지만 경제성이 없어 대부분 크롬철광(FeCr2O4)에서 얻는다.
크로뮴을 포함한 합금은 부식에 강하고 단단하기 때문에 활용 범위가 매우 넓다. 한 예로 스테인리스 스틸의 성분으로 크로뮴을 첨가하면 잘 부식되지 않고 변색되는 일이 적어 널리 쓰인다. 전기 도금에도 쓰이는데, 합금으로 사용하는 것까지 합하면 전체 크로뮴 사용량의 85%는 이러한 용도로 쓰인다.
크로뮴의 3가 양이온(Cr3+)은 체내에 미량 존재하며, 당분과 지질의 대사 과정에 필수적이라는 주장이 있으나 그에 대한 논란이 있다. Cr6+ 이온을 포함하는 크로뮴 화합물을 다량 흡입하면 독성을 나타내며 각종 암을 유발하기도 한다.
합금 및 도금
크로뮴을 각종 합금에 첨가물로 넣으면 잘 부식되지 않고 강도가 증가한다. 이 때문에 크로뮴은 도금과 합금 분야에 널리 쓰인다. 특히 철과의 합금으로 많이 사용되는데, 고속도강에는 3~5% 정도의 크로뮴이 첨가되며 스테인리스 스틸에는 보통 11% 이상 들어간다. 주로 용융된 철에 크로뮴철을 첨가하는 방식으로 제작한다.
순수한 크로뮴도 비교적 단단하고 부식에 강해 금속의 도금에도 많이 사용된다. 주로 전기도금 기술을 이용해 금속의 표면에 얇게 도금하는데, 1마이크로미터 정도로 얇게 도금하여 장식용으로 쓰는 경우와, 조금 더 두껍게 도금하여 표면이 잘 마모되지 않게 하는 용도로 나뉜다. 도금할 때는 크로뮴산 이온(CrO42-)이나 중크로뮴산 이온(Cr2O72-)이 사용된다. 그러나 환경오염 및 건강 문제 등을 유발할 수 있어 다른 도금 방법이 연구 중이다.
염색
크로뮴 화합물은 염료로 많이 사용된다. 대표적인 예로 크롬 옐로(PbCrO4)는 노란색을 내는데 가장 많이 쓰인 염료 중의 하나이다. 색이 강렬하므로 도로의 중앙선을 노랗게 칠할 때도 크롬 옐로를 사용하며, 미국이나 유럽에서는 학교 버스나 우편물 배달 차량을 칠할 때 사용한다. 또한, 프러시안 블루와 크롬 옐로를 섞으면 녹색의 Cr3+ 이온을 포함하는 산화물이 만들어지므로 크롬 그린의 제조에 사용된다. 이밖에 홍연석(PbCrO4·Pb(OH)2)에서 얻은 크롬 레드는 붉은색 염료로 많이 사용되었다. 그러나 크로뮴을 포함하는 염료는 환경오염 및 건강 문제를 유발할 수 있어 대부분 유기 화합물 등으로 대체되는 추세이다.
한편, 녹색의 크로뮴 산화물은 유리에 색을 넣거나 적외선을 반사하는 페인트로 사용한다. 특히 후자의 경우 식물의 녹색 잎과 비슷한 적외선 반사율을 나타내므로 군용 차량을 칠할 때 사용된다.
보석
소량의 크로뮴으로 인해 붉은색을 띠는 루비.
천연 루비는 산화 알루미늄 결정 속에 3가 크로뮴 이온이 포함되어 붉은색을 나타내는 것이다. 타이타늄과 철 이온이 포함되면 사파이어가 된다. 루비를 인공적으로 합성할 때도 같은 방법을 사용한다. 이러한 인조 루비는 1960년에 만들어진 최초의 레이저에도 사용되어 붉은색을 내는데 쓰였다.






댓글목록
등록된 댓글이 없습니다.