황[sulfur, 黃 ] (기호 S)
24,288
2022.09.15 08:21
첨부파일
-
- 첨부파일: K-001.png (47.8K)147 2022-09-15 08:27:56
짧은주소
본문
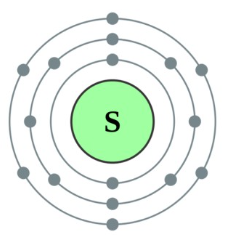
주기율표 16족에 3주기에 속하는 칼코겐(chalcogen) 원소로 원소기호는 S, 원자량은 32, 녹는점은 115.21℃, 끓는점 444.6℃이다.
상온에서 주로노란색의 고체이며 연소할 때 푸른색 불꽃을 내면서 매우 강하고 지독한 냄새가 나는 이산화황(SO2)을 생성하며
많은 동소체와 동위원소가 존재한다.
황은 상온에서는 황색 비금속 고체이며 황은 푸른색 불꽃을 내면서 타고 매우 강하고 지독한 냄새가 나는 이산화황(SO2)를 방출한다.
고체상태에서 고리왕관 모양의 S8로 존재하는데 조건에 따라 결정구조가 다른 30여 개의 동소체를 갖는다. 95.3℃ 이하에서는
α황 Sα(斜方晶系黃)가 가장 안정한 형태로 황색을 띠며 자연황이나 승화황이 이에 속한다. 물에 녹지 않고 이황화탄소에는 잘 녹으며,
알코올·벤젠·에테르에도 다소 녹는다. 모든 황은 방치해 두면 α황이 된다.
95.3℃ 이상에서는 β황 Sβ(單斜晶系黃)이 안정하며, 보통 황을 용융시킨 후 100℃에서 결정화하여 신속하게 냉각하여 석출되는
연노랑색의 결정이 β황이다. 이황화탄소, 알코올, 벤젠 등에 녹는다. 세 가지 동소체 중 가장 밀도가 크고 150℃ 이상에서 가열하여
녹은 황을 천천히 식히면 γ황 Sγ을 얻을 수 있다.
액체의 황을 물 속에서 급랭시키면 황갈색의 고무 모양 물질(고무 모양 황이라 한다)이 되는데 이것은 λ황·μ황의 혼합물로서
λ황만이 이황화탄소에 녹는다. 액체를 다시 고온으로 가열하면 기체가 되지만, 여기에는 S8(황색), S6, S4(적색), S2(황색) 등의
분자가 포함되어 있고, 고온이 될수록 해리하여 2000℃에서는 단원자의 S로 된다. 그 밖에 각종 비결정성 황이 알려져 있다.
절연체이고 열전도율이 낮으며 마찰하면 대전된다. 화학적으로는 산소와 비슷하고 상당히 활성이 강하다. 공기 중에서 가루
형태로 된 것은 상온에서 산화되며, 금·백금 이외의 금속과는 직접 반응한다.
천연으로는 자연황과 황철석·방연석·섬아연석·황동석·석고 등으로 산출되는데, 화산가스·온천·화산지대에서 황원소나
황화수소·아황산가스(이산화황)·황산 등의 형태로 존재한다. 생물체의 단백질에도 많이 함유되어 있다. 자연황은 화산지방에
많고 미국·일본·이탈리아 등이 주요 산지이다.
성냥·화학의 원료 및 약용·표백용으로 쓰인다. 황산 ·이황화탄소··성냥··흑색 화약··염료 등의 제조원료가 되며, 고무의
가황(황화·탈산황·황분말·침강황·콜로이드황 등이 사용된다)에 널리 쓰인다. 또 농약·살충제의 제조원료가 되며,
펄프공업(아황산법)·합성섬유공업에 쓰이며, 의약품으로는 국부자극제·살기생충제·살카이젠제와, 내복용의 정제황이 적합하며,
완하제로 변비와 치질환자에 사용된다. 황화 이온(S2-)을 이용한 앙금생성반응으로 용액 속에 철 이온, 구리 이온, 납 이온이나
카드뮴 이온이 들어 있는지 확인할 수 있다.
황원소는 독성이 없으나 황화합물 이산화황이나 황화수소는 독성이 있으므로 사용 시 주의해야 한다.
상온에서 주로노란색의 고체이며 연소할 때 푸른색 불꽃을 내면서 매우 강하고 지독한 냄새가 나는 이산화황(SO2)을 생성하며
많은 동소체와 동위원소가 존재한다.
황은 상온에서는 황색 비금속 고체이며 황은 푸른색 불꽃을 내면서 타고 매우 강하고 지독한 냄새가 나는 이산화황(SO2)를 방출한다.
고체상태에서 고리왕관 모양의 S8로 존재하는데 조건에 따라 결정구조가 다른 30여 개의 동소체를 갖는다. 95.3℃ 이하에서는
α황 Sα(斜方晶系黃)가 가장 안정한 형태로 황색을 띠며 자연황이나 승화황이 이에 속한다. 물에 녹지 않고 이황화탄소에는 잘 녹으며,
알코올·벤젠·에테르에도 다소 녹는다. 모든 황은 방치해 두면 α황이 된다.
95.3℃ 이상에서는 β황 Sβ(單斜晶系黃)이 안정하며, 보통 황을 용융시킨 후 100℃에서 결정화하여 신속하게 냉각하여 석출되는
연노랑색의 결정이 β황이다. 이황화탄소, 알코올, 벤젠 등에 녹는다. 세 가지 동소체 중 가장 밀도가 크고 150℃ 이상에서 가열하여
녹은 황을 천천히 식히면 γ황 Sγ을 얻을 수 있다.
액체의 황을 물 속에서 급랭시키면 황갈색의 고무 모양 물질(고무 모양 황이라 한다)이 되는데 이것은 λ황·μ황의 혼합물로서
λ황만이 이황화탄소에 녹는다. 액체를 다시 고온으로 가열하면 기체가 되지만, 여기에는 S8(황색), S6, S4(적색), S2(황색) 등의
분자가 포함되어 있고, 고온이 될수록 해리하여 2000℃에서는 단원자의 S로 된다. 그 밖에 각종 비결정성 황이 알려져 있다.
절연체이고 열전도율이 낮으며 마찰하면 대전된다. 화학적으로는 산소와 비슷하고 상당히 활성이 강하다. 공기 중에서 가루
형태로 된 것은 상온에서 산화되며, 금·백금 이외의 금속과는 직접 반응한다.
천연으로는 자연황과 황철석·방연석·섬아연석·황동석·석고 등으로 산출되는데, 화산가스·온천·화산지대에서 황원소나
황화수소·아황산가스(이산화황)·황산 등의 형태로 존재한다. 생물체의 단백질에도 많이 함유되어 있다. 자연황은 화산지방에
많고 미국·일본·이탈리아 등이 주요 산지이다.
성냥·화학의 원료 및 약용·표백용으로 쓰인다. 황산 ·이황화탄소··성냥··흑색 화약··염료 등의 제조원료가 되며, 고무의
가황(황화·탈산황·황분말·침강황·콜로이드황 등이 사용된다)에 널리 쓰인다. 또 농약·살충제의 제조원료가 되며,
펄프공업(아황산법)·합성섬유공업에 쓰이며, 의약품으로는 국부자극제·살기생충제·살카이젠제와, 내복용의 정제황이 적합하며,
완하제로 변비와 치질환자에 사용된다. 황화 이온(S2-)을 이용한 앙금생성반응으로 용액 속에 철 이온, 구리 이온, 납 이온이나
카드뮴 이온이 들어 있는지 확인할 수 있다.
황원소는 독성이 없으나 황화합물 이산화황이나 황화수소는 독성이 있으므로 사용 시 주의해야 한다.






댓글목록
등록된 댓글이 없습니다.